高通量单细胞转录组测序(scRNA-seq)在植物和农学研究中,长期受制于单细胞制备环节的技术瓶颈。
中国科学院分子植物科学卓越创新中心等单位通过底层技术创新,开发了新型植物单细胞制备方法 FX-Cell,
为难以处理的植物组织与实地样本提供了更稳定、更高质量的单细胞获取路径。
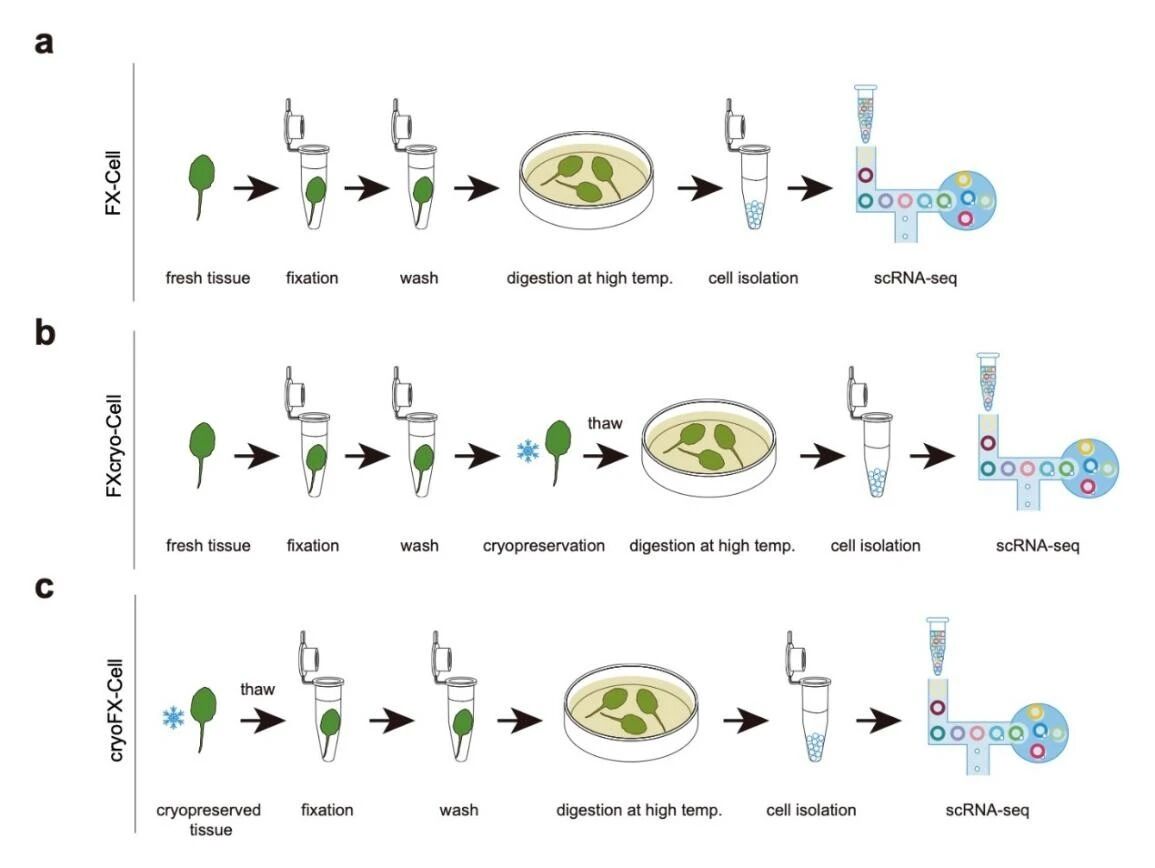
FX-Cell及其衍生技术流程
FX-Cell 方法对传统原生质体制备流程进行了系统性改进。研究团队首先发现,提高酶解温度可显著增强制备效率;
但为避免高温引起的转录组扰动,团队在酶解前使用 Farmer 溶液对组织进行固定,从源头降低表达噪声与应激偏差。
同时,团队通过 GMP Sepharose/Agarose 柱亲和纯化去除酶解液中的 RNase,并在体系中添加 tRNA、tri-GMP 等 RNase 抑制剂,有效保护 mRNA 稳定性,从而提升单细胞基因捕获数与数据完整度。
在水稻与拟南芥根尖的测试中,FX-Cell 表现出高重复性;其数据质量与常规 scRNA-seq 相当,优于 snRNA-seq,
且基本消除了原生质体化带来的转录组偏差。
基于 FX-Cell,团队进一步开发出两种衍生技术:FXcryo-Cell(先固定后 -80°C 保存再酶解)与 cryoFX-Cell(先冷冻保存再固定与酶解)。以水稻根尖为例,二者获得的单细胞图谱质量与 FX-Cell 相当,为冻存样本的后续单细胞分析提供了可复用流程。
这些技术实现了对难以酶解组织、农田实地样品及冻存样本的高质量 scRNA-seq,为构建植物单细胞图谱与推动农业精准研究提供了重要工具支撑。
